珈创生物 —— 生物技术服务与研发为一体的高新技术企业
优质高效透明
High quality, efficient and transparent
发布时间:2022-05-26 09:04 信息来源: 阅读次数: 次
小珈将在#药典解读#栏目里,用思维导图帮大家梳理相关药典思路,盘点其重点内容,欢迎大家去后台留言探讨。本文解读的是:《生物制品生产检定用动物细胞基质制备及质量控制》中华人民共和国药典,2020年版,三部,生物制品通则。
本通则的适用范围
人用生物制品生产用动物细胞基质及检定用动物细胞
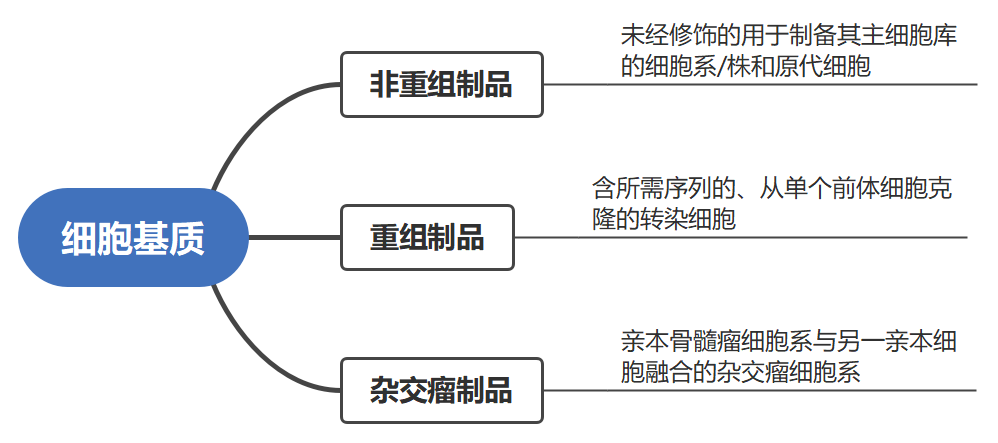
细胞基质的概念
系指可用于生物制品生产的所有动物或人源的连续传代细胞系、二倍体细胞株及原代细胞。
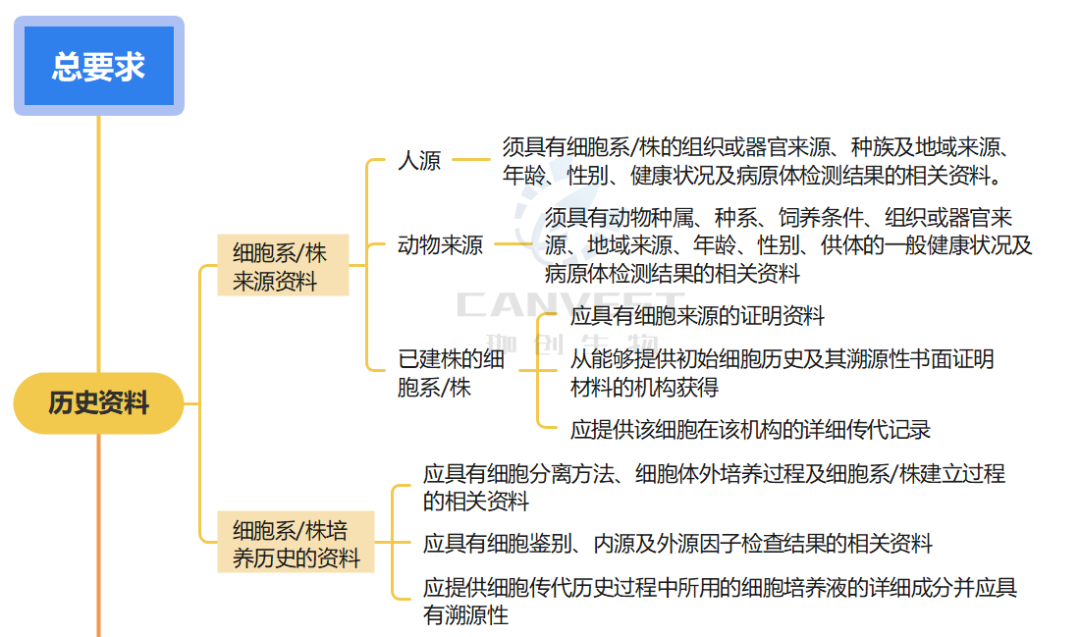
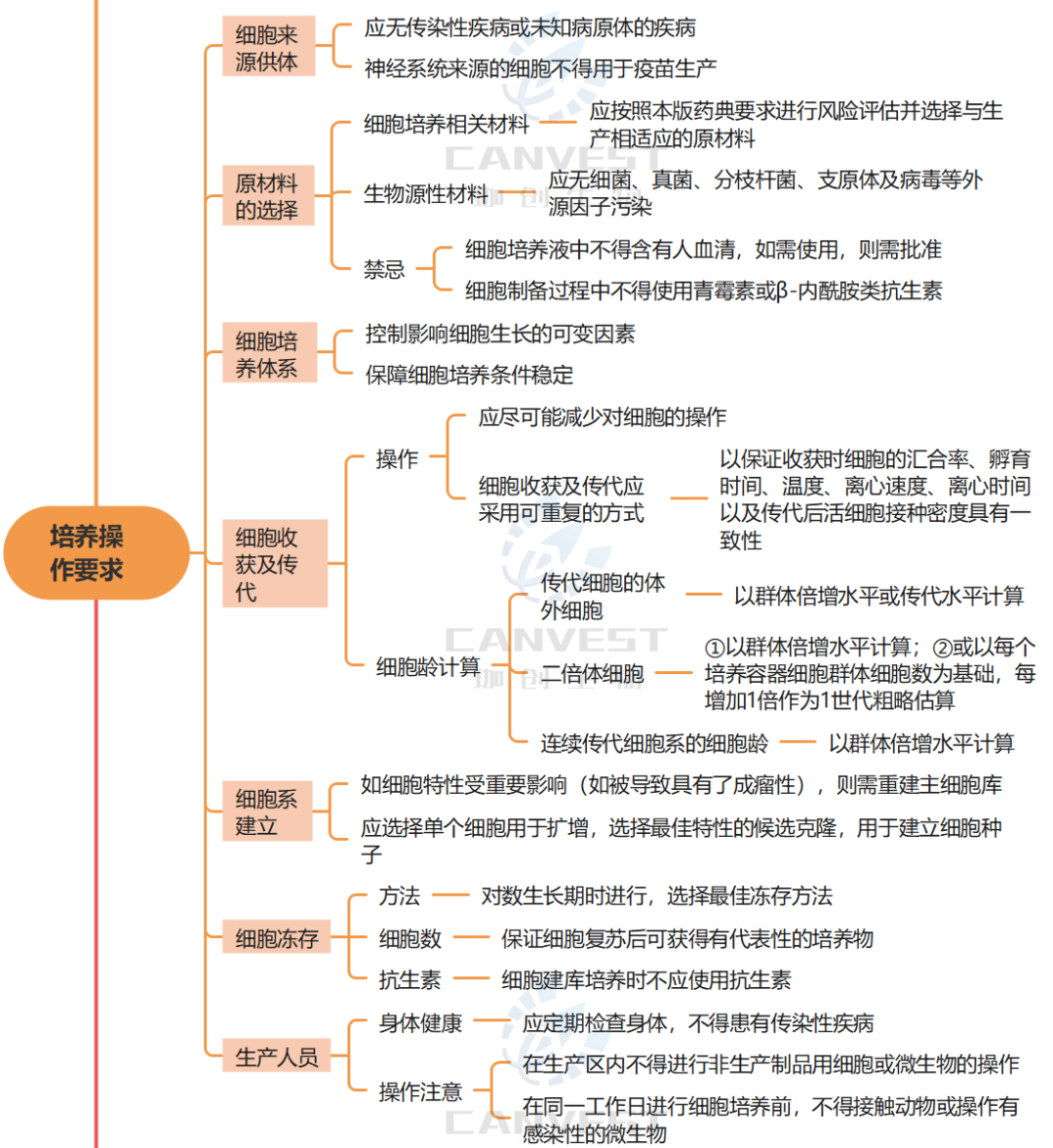
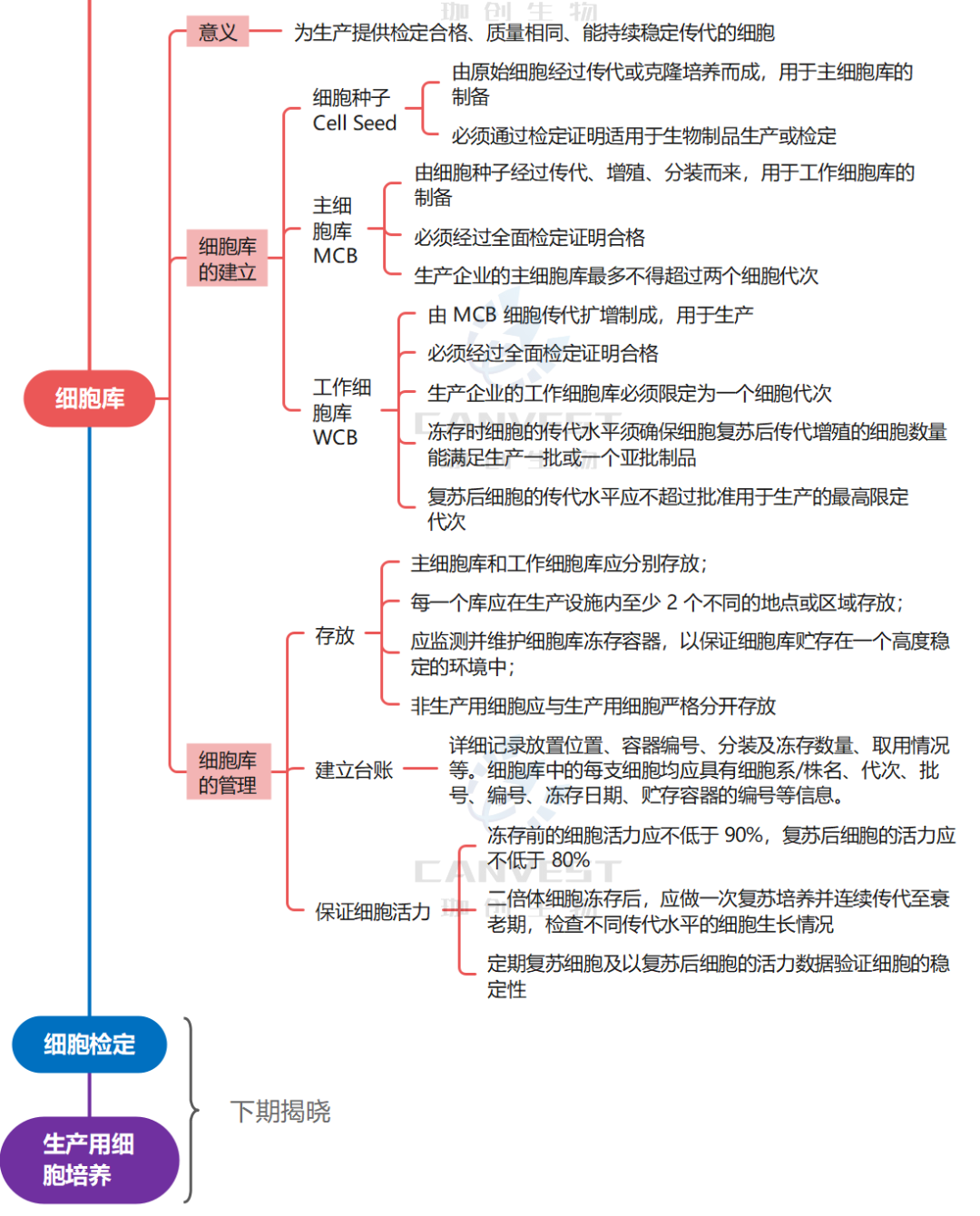
对生产用细胞基质总的要求
上
点击看大图▼
下期将带您了解细胞检定的相关要求;相关技术指南,将在后续推文中介绍,请持续关注哦~
珈创生物细胞检定相关服务
武汉珈创生物技术股份有限公司,创建于2011年,是一家集生物技术服务与研发为一体的高新技术企业,专注于为生物药品/制品的生产企业及研发机构提供各类细胞(含重组细胞、干细胞、免疫细胞等)及原辅料的质量检测、病毒清除工艺验证技术服务。
按药典要求,细胞系/株需要经过全面检定合格后,方可用于生产。
珈创生物在细胞检定领域,拥有丰富的经验积淀:其首席专家郑从义教授(原中国典型培养物保藏中心主任)自 1985 年开始从事细胞保藏/检测及细胞质量控制研究,至今已有37年,曾赴美国ATCC、荷兰真菌保藏所(CBS)、英国培养物保藏中心(NCTC)做访问学者,拥有深厚的学术积累;公司全部检测人员都经过系统、专业的岗位培训,其核心检测人员在本领域内的从业经验都在5年以上。
珈创生物应广大客户需求,已经完成参考《美国药典 USP43》、ICH指导原则及相关法规要求的技术升级,可提供涵盖细胞鉴别、纯度(无菌检查、支原体检查及内外源病毒因子检查等)和病毒清除工艺验证等符合中美欧申报要求的检测服务。
